Хлористый водород представляет собой газ, примерно в 1,3 раза тяжелее воздуха. Он без цвета, но с резким удушливым и характерным запахом. При температуре минус 84С хлористый водород переходит из газообразного в жидкое состояние, а при минус 112С затвердевает. Хлороводород растворяется в воде. Один литр H2O способен поглотить до 500 мл газа. Раствор его называется хлороводородной или соляной кислотой. Концентрированная соляная кислота при 20С характеризуется максимально возможной основного вещества, равной 38 %. Раствор — это сильная одноосновная кислота (на воздухе «дымит», а при наличии влаги образует кислотный туман), она имеет также и другие названия: хлористоводородная, а по украинской номенклатуре — хлоридная кислота. Химическая формула может быть представлена в таком виде: HCl. Молярная масса составляет 36,5 г/моль. Плотность соляной кислоты концентрированной при 20С равняется 1,19 г/см³. Это вредное вещество, которое относится ко второму классу опасности.
В «сухом» виде хлороводород не может взаимодействовать даже с активными металлами, но при наличии влаги реакция протекает достаточно энергично. Эта сильная хлористоводородная кислота способна реагировать со всеми металлами, которые стоят левее водорода в ряду напряжений. Кроме того, оно взаимодействует с основными и амфотерными окислами, основаниями, а также с солями:
- Fe + 2HCl → FeCl2 + H2;
- 2HCl + CuO → CuCl2 + H2O;
- 3HCl + Fe(OH)3 → FeCl3 + 3H2O;
- 2HCl + Na2CO3 → 2NaCl + H2O + CO2;
- HCl + AgNO3 → AgCl↓ + HNO3.
Кроме общих свойств, характерных для каждой сильной кислоты, соляная кислота в концентрированном виде реагирует с различными окислителями, выделяя свободный хлор. Соли этой кислоты называют хлоридами. Почти все они хорошо растворяются в воде и полностью диссоциируют на ионы. Слаборастворимыми являются: хлористый свинец PbCl2, хлористое серебро AgCl, хлорид одновалентной ртути Hg2Cl2 (каломель) и хлорид одновалентной меди CuCl. Хлористый водород способен вступать в реакцию присоединения к с двойной или тройной связью, при этом образуются хлорпроизводные органические соединения.
В условиях лаборатории хлороводород получается при воздействии на сухой серной кислотой концентрированной. Реакция в разных условиях может протекать с образованием солей натрия (кислой или средней):
- H2SO4 + NaCl → NaHSO4 + HCl
- H2SO4 + 2NaCl → Na2SO4 + 2HCl.
Первая реакция идет до конца при слабом нагревании, вторая — при более высоких температурах. Поэтому в лаборатории хлороводород лучше получать первым способом, для чего количество серной кислоты рекомендуется брать из расчета получения кислой соли NaHSO4. Затем, растворением хлористого водорода в воде получается соляная кислота. В промышленности ее получают, сжигая в атмосфере хлора водород или воздействуя на сухой хлорид натрия (только по второму серной кислотой концентрированной. Также хлороводород получается как побочный продукт при хлорировании насыщенных органических соединений. В промышленности хлористый водород, полученный одним из приведенных выше способов, растворяют в специальных башнях, в которых жидкость пропускают сверху вниз, а газ подают снизу вверх, то есть по принципу противотока.
Соляная кислота транспортируется в специальных гуммированных цистернах или контейнерах, а также в бочках полиэтиленовых емкостью 50 л или бутылях стеклянных вместимостью 20 л. При существует риск образования взрывоопасных водородовоздушных смесей. Поэтому должен быть полностью исключен контакт образовавшегося в результате реакции водорода с воздухом, а также (с помощью антикоррозионных покрытий) контакт кислоты с металлами. Перед выводом аппаратов и трубопроводов, где она хранилась или транспортировалась, в ремонт, необходимо проводить продувки азотом и контролировать состояние газовой фазы.
Хлороводород широко применяется в промышленных производствах и в лабораторной практике. Он используется для получения солей и в качестве реактива в аналитических исследованиях. Соляная кислота техническая выпускается по ГОСТ 857-95 (текст идентичен международному стандарту ИСО 905-78), реактив — по ГОСТ 3118-77. Концентрация технического продукта зависит от марки и сорта и может быть 31,5 %, 33 % или 35 %, а внешне продукт бывает желтоватого цвета из-за содержания примесей железа, хлора и других химических веществ. Реактивная кислота должна быть бесцветной и прозрачной жидкостью с массовой долей от 35 до 38 %.
Соляная кислота, также известная как пищевая добавка Е507, представляет собой водный раствор газообразного хлористого водорода. Она находится в организме человека как основной компонент желудочного сока, поддерживающий рН на уровне 1-2 в желудке (желудок уникально развился, чтобы справиться с высокой кислотностью).
HCl является важным и широко используемым химическим веществом. Наиболее частые сферы применения – это в процессе травления металлов, кислотной обработки нефти, производство продуктов питания, производство хлорида кальция и переработка руды.
Производство Е507
Соляная кислота производится чаще всего четырьмя основными методами: хлорирование органических химических веществ; сочетание водорода и хлора; процесс получения соли серной кислоты; при производстве в качестве побочного продукта.
Большинство хлористоводородной кислоты получают из хлорирования органических химических веществ. Полностью сухая (безводная) газообразная соляная кислота не разрушает сталь или , поэтому ее можно хранить и транспортировать в цилиндрах из стали в сжатом виде.
Использование в пищевой промышленности
Пищевая промышленность использует Е507 при переработке различных продуктов. Основное ее применение в пищевой промышленности заключается в производстве кукурузных сиропов, особенно с высоким содержанием . Также она часто встречается в , входит в состав , фруктозы.
Соляную кислоту можно также использовать для кислотного модифицирования кукурузного и для регулирования рН промежуточных и конечных продуктов.
Наиболее частое использование – это производство безалкогольных напитков, на которые приходится 70-75% спроса.
Е507 также используется в других областях пищевой промышленности, включая производство гидролизованного растительного и . Она используется для подкисления дробленых костей, для производства желатина и в качестве подкислителя для продуктов, таких как соусы, и консервы.
 Соляная кислота часто используется при производстве:
Соляная кислота часто используется при производстве:
- искусственных подсластителей;
- и хлорида холина (оба используются главным образом в качестве добавок для корма для животных);
- лимонной кислоты;
- кукурузного крахмала;
- безалкогольных напитков;
- соевого соуса.
Применение в промышленности
Большая часть соляной кислоты, потребляемой в промышленности, используется для регенерации ионообменных смол, которые используются для удаления примесей. Она используется в основном для непрерывных операций по травлению стали, также используется в травлении алюминия и для очистки металла.
HCl используется как для удаления ржавчины, окалины, так и нежелательных карбонатных отложений в нефтяных скважинах для стимулирования потока сырой нефти или газа в скважину.
Нейтрализация соляной кислоты известняком (CaCO3) вызывает образование хлорида кальция. Хлорид кальция используется для пылеулавливания, промышленной обработки, добычи нефти, обработки бетона и балластировку шин.
Водная соляная кислота используется во множестве различных применений. К ним относятся извлечение полудрагоценных металлов из использованных катализаторов, использование в качестве катализатора в синтезе, регулирование рН, регенерация ионообменных смол, используемых в очистке сточных вод и электроснабжения, нейтрализация щелочных продуктов или отходов, а также подкисление рассола для использования в производстве хлора и каустической соды.
Применение в быту
HCl является одним из самых сильных в настоящее время чистящих средств, она чрезвычайно эффективна и рекомендуется в качестве очистителя, может использоваться для очистки любого продукта, который может противостоять его последствиям.
HCl используется для нейтрализации , что делает ее безопасной для купальщиков.
Чаще всего уровень рН высокий; лучший способ снизить рН – это медленно заливать соляную кислоту непосредственно в глубокий конец бассейна, пока насос бассейна включен, а вода циркулирует.
Применение в медицине
Фармацевтическая промышленность потребляет соляную кислоту в качестве катализатора в синтезе, для контроля рН, для деионизации воды и в качестве восстановителя (например, при производстве аскорбиновой кислоты и парааминобензойной кислоты).
Также может использоваться для пожилых людей или людей, которые страдают от кислотной недостаточности в пищеварительной системе
Безопасность пищевой добавки
HCl в концентрированной форме является сильным коррозионным агентом, и последствия ее воздействия хорошо известны. При обращении с этой кислотой следует проявлять особую осторожность. В высоких концентрациях HCl выпускает кислотный туман в воздух. Во избежание травм или раздражения при работе с данным веществом следует надевать защитную одежду, а также перчатки и защитные очки.
Пары соляной кислоты могут вызывать кашель, охриплость, одышку, спазм гортани, язвы в дыхательных путях и даже образование жидкости в легких.
Однако, поскольку она используется в пищевой промышленности в качестве пищевой добавки для регулирования рН, соляная кислота нейтрализуется или забуферивается пищей, к которой она добавляется. Таким образом, человек потребляет не саму кислоту, а хлоридный ион в солях, которые образуются в процессе реакции нейтрализации.
Небольшие количества соляной кислоты, которые могут сохраняться в пищевых продуктах или напитках, в свою очередь будут нейтрализованы и забуферированы во время приема внутрь и пищеварения, или после всасывания. HCl также является естественным секреторным продуктом желудка животных, включая человека (около 0,5% концентрации в желудочном соке).
Нормальное ее производство в желудке в несколько раз превышает количество, которое можно получить из продуктов. Поэтому о ее безопасности, во время приема с пищей, в установленных безопасных количествах, не стоит беспокоиться.
Водный раствор хлористого водорода назвали соляной кислотой потому, что издавна его получали из поваренной соли, действуя на нее серной кислотой. Этот, так называемый сульфатный, способ производства соляной кислоты долгое время был единственным. Затем стали получать синтетический хлористый водород из хлора и водорода. Кроме того, значительные количества хлористого водорода получают в качестве побочного продукта при хлорировании органических веществ и других продуктов.
Таким образом, в промышленности соляную кислоту получают следующими способами:
- - сульфатным;
- - синтетическим;
- - из абгазов (побочных газов) ряда процессов.
Во всех случаях производство соляной кислоты (реактивной, полученной сульфатным способом, синтетической, абгазной) состоит из двух стадий:
- 1) получения хлористого водорода
- 2) поглощения (абсорбции) хлористого водорода водой.
В зависимости от способа отвода теплоты абсорбции, которая достигает 72,8 кДж/моль процессы разделяются на изотермические (при постоянной температуре), адиабатические (без теплообмена с окружающей средой) и комбинированные.
Сульфатный метод: основан на взаимодействии хлорида натрия с серной кислотой Н 2 SO 4 (92-93%) при 500-550°С.
2NaCl + H 2 SO 4 > Na 2 SO 4 + 2HCl
Менее концентрированную серную кислоту не применяют, так как в этом случае хлористый водород был бы чрезмерно разбавлен парами воды, что затруднило бы получение концентрированной соляной кислоты. В технологическом процессе предпочтительнее применение крупнозернистой выварочной соли вследствие ее пористости? она легко пропитывается кислотой с образованием однородной массы. Однако выварочная соль содержит переменное количество влаги, что затрудняет дозировку сырья и регулирование температурного режима печей. Каменная соль характеризуется постоянной влажностью, но она более загрязнена примесями CaSO 4 , Fe 2 O 3 и другими, переходящими в сульфат натрия. Помимо этого, применение каменной соли связано с необходимостью ее измельчения и более интенсивного перемешивания с серной кислотой.
Реакционные газы, отходящие от муфельных печей, содержат от 50-65% хлороводорода, а газы от реакторов с кипящим слоем до 5% НСl. В настоящее время предложено заменить серную кислоту на смесь SO 2 и О 2 c использованием в качестве катализатора Fe 2 O 3 и проведением процесса при температуре 540°С.
Синтез хлористого водорода из элементов дает концентрированный хлористоводородный газ (содержащий 80-90% и больше HCl), легко поддающийся сжижению, а поглощение его дистиллированной водой позволяет получать чистую реактивную кислоту, концентрация которой при необходимости может достигать 38%.
В основе прямого синтеза соляной кислоты лежит цепная реакция горения:
Н 2 + Сl 2 - 2НС1 + 184,7 кДж.
Реакция инициируется светом, влагой, твердыми пористыми веществами (древесный уголь, губчатая платина) и некоторыми минеральными веществами (кварц, глина). Абсолютно сухие хлор и водород не взаимодействуют между собой. Присутствие следов влаги ускоряет реакцию столь интенсивно, что она может произойти со взрывом. В производственных установках осуществляется спокойное, не взрывное горение водорода в токе хлора. Водород подается с избытком в 5-10%, что позволяет полностью использовать более ценный хлор и получить незагрязненную хлором соляную кислоту.
Сжигание смеси хлора и водорода производится в печах различных конструкций, представляющих собой небольшие камеры из огнеупорного кирпича, плавленого кварца, графита или металла. Наиболее современным материалом, предотвращающий загрязнение продукта является графит, импрегнированный фенолоформальдегидными смолами. Для предотвращения взрывного характера горения реагенты смешивают непосредственно в факеле пламени горелки. В верхней зоне камер сжигания устанавливают теплообменники для охлаждения реакционных газов до 150-160°С. Мощность современных графитовых печей достигает 65 т/сут. (в пересчете на соляную кислоту содержащую 35% НСl).
Получение соляной кислоты из хлора и водорода? основной способ промышленного производства данного продукта.
В случае дефицита водорода применяют различные модификации процесса. Например, пропускают смесь Сl 2 с водяным паром через слой пористого раскаленного угля:
2С1 2 + 2Н 2 О + С > 4НС1 + СО 2 + 288,9 кДж.
Температура процесса составляет 1000-1600°С, зависит от типа угля и наличия в нем примесей, являющихся катализаторами, например Fe 2 O 3.
Перспективным является также использование смеси СО с парами воды:
СО + Н 2 О + Сl 2 > 2НС1 + СО 2 .
Значительное количество соляной кислоты в настоящее время получают из абгазного хлороводорода НСl, образующегося при хлорировании и дегидрохлорировании органических соединений, пиролизе хлорорганических отходов, хлоридов металлов, получении калийных нехлорированных удобрений и др. Абгазные газы содержат различные количества хлороводорода, инертные примеси (N 2 , Н 2 , СН 4), малорастворимые в воде органические вещества (хлорбензол, хлорметаны), водорастворимые вещества (уксусная кислота, хлораль), кислые примеси (Cl 2 , HF, О 2) и воду. При содержании инертных примесей менее 40%, является целесообразным применение изотермической абсорбции НСl в абгазных газах. Наиболее перспективными являются пленочные абсорберы, позволяющие извлекать из исходного абгаза от 65% до 85% НСl.
В российской промышленности для получения соляной кислоты наиболее широко применяют схемы адиабатической абсорбции. Абгазные газы вводят в нижнюю часть абсорбера, а воду (или разбавленную соляную кислоту) - противотоком в верхнюю. Соляная кислота нагревается до температуры кипения благодаря теплоте растворения НСl. Зависимость изменения температуры абсорбции и концентрации НСl показана на рисунке 1.
Температура абсорбции определяется температурой кипения кислоты соответствующей концентрации, максимальная температура кипения азеотропной смеси находится около 110°С.
Рис. 1.
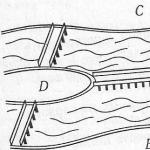
Типовая схема адиабатической абсорбции НСl из абгазов, образующихся при хлорировании (например, при получении хлорбензола), представлена на рисунке 2. Хлороводород поглощается в абсорбере 1, а остатки малорастворимых в воде органических веществ отделяют от воды после конденсации в аппарате 2, доочищают в хвостовой колонне 4 и сепараторах 3, 5 и получают товарную соляную кислоту.

Рис. 2: Схема типовой адиабатической абсорбции соляной кислоты из абгазов. 1 ? адиабатический абсорбер; 2 ? конденсатор; 3, 5 ? сепараторы; 4 ? хвостовая колонна; 6 ? сборник органической фазы; 7 ? сборник водной фазы; 8, 12 ? насосы; 9 ? отдувочная колонна; 10 ? теплообменник; 11 ? сборник товарной кислоты
Получение соляной кислоты из абгазных газов с использованием комбинированной схемы абсорбции представлено в виде типовой схемы на рисунке 3. В колонне адиабатической абсорбции получают соляную кислоту пониженной концентрации, но свободную от органических примесей. Кислоту с повышенной концентрацией НС1 производят в колонне изотермической абсорбции при пониженных температурах. Степень извлечения HCl из абгазов при использовании в качестве абсорбентов разбавленных кислот составляет 95- 99%. При использовании в качестве абсорбента чистой воды степень извлечения почти полная.

Рис. 3: Схема типовой комбинированной абсорбции соляной кислоты из абгазных газов 1 - колонна адиабатической абсорбции; 2 - конденсатор; 3 - отделитель газов; 4 - сепаратор; 5 - холодильник; 6, 9 - сборники кислоты; 7 - насосы; 8 - изотермический абсорбер.
Получение. Соляную кислоту получают путем растворения хлороводорода в воде.
Обратите внимание на прибор изображенный на рисунке слева. Его используют для получения соляной кислоты. Во время процесса получения соляной кислоты, следят за газоотводной трубкой, она должна находиться вблизи уровня воды, а не быть погруженной в нее. Если за этим не следить, то из-за большой растворимости хлороводорода вода попадет в пробирку с серной кислотой и может произойти взрыв.
В промышленности соляную кислоту обычно получают путем сжигания водорода в хлоре и растворении продукта реакции в воде.
Физические свойства. Растворяя хлороводород в воде, можно получить даже 40% раствор соляной кислоты с плотностью 1,19 г/см 3 . Однако имеющаяся в продаже концентрированная соляная кислота содержит около 0,37 массовых долей, или около 37% хлороводорода. Плотность данного раствора составляет примерно 1,19 г/см 3 . Пр разбавлении кислоты плотность ее раствора уменьшается.
Концентрированная соляная кислота является бесценным раствором, сильно дымящая во влажном воздухе, обладающая резким запахом вследствие выделения хлороводорода.
Химические свойства. Соляная кислота обладает рядом общих свойств, которые характерны большинству кислот. Помимо этого, она обладает некоторыми специфическими свойствами.
Свойства HCL, общие с другими кислотами: 1) Изменение окраски индикаторов 2) взаимодействие с металлами 2HCL + Zn → ZnCL 2 + H 2 3) Взаимодействие с основными и амфотерными оксидами: 2HCL + CaO → CaCl 2 + H 2 O; 2HCL + ZnO → ZnHCL 2 + H 2 O 4) Взаимодействие с основаниями: 2HCL + Cu (OH) 2 → CuCl 2 + 2H 2 O 5) Взаимодействие с солями: 2HCL + CaCO 3 → H 2 O + CO 2 + CaCL 2
Специфические свойства HCL: 1) Взаимодействие с нитратом серебра (нитрат серебра является реактивом на соляную кислоту и ее соли); выпадет осадок белого цвета, который не растворяется в воде, ни в кислотах: HCL + AgNO3 → AgCL↓ + HNO 3 2) Взаимодействие с окислителями (MnO 2 , KMnO, KCLO 3 и др.): 6HCL + KCLO 3 → KCL +3H 2 O + 3CL 2
 Применение.
Огромное количество соляной кислоты расходуется для удаления оксидов железа перед покрытием изделий из этого металла другими металлами (оловом, хромом, никелем). Для того чтобы соляная кислота реагировала только с оксидами, но не с металлом, к ней добавляют особые вещества, которые называются ингибиторами. Ингибиторы
– вещества замедляющие реакции.
Применение.
Огромное количество соляной кислоты расходуется для удаления оксидов железа перед покрытием изделий из этого металла другими металлами (оловом, хромом, никелем). Для того чтобы соляная кислота реагировала только с оксидами, но не с металлом, к ней добавляют особые вещества, которые называются ингибиторами. Ингибиторы
– вещества замедляющие реакции.
Соляная кислота применяется для получения различных хлоридов. Ее используют для получения хлора. Очень часто, раствор соляной кислоты прописывают больным с пониженной кислотностью желудочного сока. Соляная кислота находится у каждого в организме, она входит в состав желудочного сока, который необходим для пищеварения.
В пищевой промышленности соляная кислота применяется только в виде раствора. Она используется для регулирования кислотности при производстве лимонной кислоты, желатина или фруктозы (Е 507).
Не стоит забывать, что соляная кислота опасна для кожи. Еще большую опасность она представляет для глаз. Воздействуя на человека, она может вызвать разрушение зубов, раздражение слизистых оболочек, удушье.
Помимо этого, соляная кислота активно применяется в гальванопластике и гидрометаллургии (удаление накипи, ржавчины, обработка кожи, химреактивы, в качестве растворителя породы при добыче нефти, при производстве каучуков, глутамината натрия, соды, Сl 2). Соляная кислота используется для регенерации Сl 2 , в органическом синтезе (для получения винилхлорида, алкилхлоридов и т.д.) Она может использоваться в качестве катализатора при получении дифенилолпропана, алкилирование бензола.
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.

Соляной кислотой называется водный раствор хлороводорода. Он представляет собой суспензию с ярко выраженным запахом. Цвет у него прозрачный. Это сильная одноосновная кислота, отличающаяся особой едкостью. При взаимодействии с воздухом начинает «дымиться». Если обратить внимание на технический раствор, то он отличается легким лимонным оттенком из-за наличия в нем определенных примесей железа и хлора. В незначительном объеме этот компонент присутствует в желудочном соке человека. Соли данного раствора называются хлоридами.
Что касается физических свойств рассматриваемого вещества, то они сильно зависят от концентрации растворенного хлороводорода. Нередко используют именно разбавленную кислоту, которая имеет в составе не более десяти процентов хлористого водорода.
Нужно заметить, что она является летучим соединением, потому что при нагревании может улетучиваться полностью. К тому же, вещество вступает в реакцию с внушительным количеством различных металлов. Но, не все из них могут поддаваться влиянию этого раствора. К примеру, такие, как золото, серебро, свинец, вольфрам, а также платина этой кислотой не растворяются. А вот некоторые металлы, не являющиеся драгоценными, при растворении в соляной кислоте, превращаются в хлориды. К ним можно причислить цинк.
Сферы применения соляной кислоты
Применение данного соединения разнообразно. К примеру, пищевая промышленность задействует это вещество для создания специальной пищевой добавки Е507. Последняя используется для производства спиртных напитков, в частности для изготовления водки и всевозможных сиропов. Задействование соляной кислоты для создания напитков и продуктов питания объясняется тем, что соединение выступает так называемым регулятором кислотного состояния пищевых продуктов.
Использование в металлургии
Кислоту еще активно используют в металлургии. Но, нужно заметить, что здесь наиболее востребована именно техническая разновидность вещества. Его применяют для качественного и эффективного очищения металлов перед непосредственным паянием или лужением.
Важно обратить внимание, что еще она используется в гидрометаллургии и гальванопластике. При помощи соляной кислоты осуществляется травление и декапирование.
Применение в медицине
Помимо всего прочего, вещество также применяется в медицине. Это объясняется тем, что оно является природной частью желудочного сока человека. В минимальной концентрации его назначают для применения внутрь в смеси с ферментом пепсином. Данное соединение необходимо при недостаточной кислотности.
Важно обратить внимание на то, чтобы использование соляной кислоты в промышленных целях не создавало никаких проблем, необходимо с предельной ответственностью подходить к выбору разновидности данного соединения и его концентрации.
Использование в быту
Мало кто задумывался о составе популярных моющих средств, которые мы применяем каждый день для чистки различных поверхностей. Немногие знают о том, что некоторые из этих химических составов имеют в себе соляную кислоту. Наиболее действенными являются химические средства, предназначенные для чистки унитазов. Они отличаются высокой кислотностью. Именно в их составе имеется данный активный компонент. Для того чтобы уберечь свои руки от негативного воздействия агрессивного состава необходимо работать исключительно в перчатках из плотной резины. Благодаря им можно уберечь руки от появления сыпи и аллергии.
Экономные хозяйки применяют данный раствор в домашних условиях в качестве эффективного средства, предназначенного для выведения пятен. Еще оно дает возможность избавиться от некрасивых следов ржавчины и чернил на одежде. Кислоту необходимо обязательно хранить в специальных емкостях из высокопрочного стекла в местах, которые недоступны детям. Если эта кислота случайно попала на уязвимые слизистые оболочки или на неприкрытую кожу, то следует немедленно промыть пораженный участок кожного покрова под проточной водой. Использование данного ингредиента в домашних условиях должно производиться с соблюдением главных и общепринятых правил безопасности.
Соляную кислоту используют не только для того, чтобы бороться со сложновыводимыми пятнами на одежде. Еще это прекрасное средство для борьбы с накипью. Чтобы не ухудшить ситуацию при очистке загрязненной посуды, следует использовать раствор определенной концентрации. Для данной цели подойдет именно ингибированная кислота, использование которой позволяет сохранить посуду целой и невредимой.
Чтобы держать свое жилище и одежду в идеальной чистоте, вам необходимо приобрести для себя соляную кислоту. Она, как известно, может представлять опасность для человека, поэтому нужно крайне осторожно с ней обращаться. При неправильном обращении может вызывать сильнейшие химические ожоги. Особенно разрушительным является ее попадание на слизистую оболочку глаза.
Применение в строительстве
Немногие знают о том, что для улучшения и модернизации многих процессов в строительстве используется соляная кислота. Ее добавляют в бетон для повышения его морозостойкости. К тому же, состав намного быстрее застывает, а кладка приобретает устойчивость к влаге. Еще кислоту используют в качестве окислителя от известняка.
Производство соляной кислоты
Данное вещество получают путем полного растворения хлороводорода в виде газа в обычной водной среде. А вот сам хлороводород появляется в результате сжигания водорода в хлоре. Полученное таким образом соединение называется синтетическим. Еще рассматриваемую кислоту можно получить из специальных абгазов — побочных газов, которые появляются при разных процессах. К примеру, при хлорировании углеводородов. Важно отметить, что хлороводород, который имеется в составе этих газов, называется абгазным. В последние годы количество абгазной кислоты в объеме производства постоянно увеличивается, вытесняя кислоту, которую получают методом сжигания водорода в хлоре. Но, все же, полученная таким простым методом соляная кислота имеет в составе меньше посторонних ингредиентов и задействуется при необходимости достижения максимальной чистоты. Хлороводород хорошо растворяется в воде.